Programa Departamental de Farmacovigilancia
Con base a lo establecido en las Resoluciones 1403 de 2007 del Ministerio de la Protección Social y la 2004009455 de 2004 del Instituto Nacional de Vigilancia de Medicamentos y Alimentos y el Decreto 780 de 2016 del Ministerio de Salud y Protección Social; la Secretaría de Salud del Tolima – la Dirección de oferta y prestaciòn de servicios, crea el programa de departamental de Farmacovigilancia.
Objetivos
Mejorar la salud pública y la seguridad en cuanto al uso de los medicamentos en el Departamento del Tolima.
Detectar los problemas relacionados con el uso de medicamento y comunicar oportunamente.
Fomentar el uso racional de los medicamentos con el fin de prevenir daños y maximizar los beneficios que proporcionan estos.
Promover la educación y materia de farmacovigilancia en el Departamento del Tolima.
Definiciones
Farmacovigilancia: Ciencia y actividades relativas a la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos o cualquier otro problema relacionado con ellos.
Identificación y valoración de los efectos del uso, agudo y crónico, de los tratamientos farmacológicos en el conjunto de la población o en subgrupos de pacientes expuestos a tratamientos específicos. Se ha sugerido que, en sentido estricto, se debe distinguir monitorización de farmacovigilancia.
Clasificación de eventos adversos según su gravedad
Evento adverso grave: En estudios clínicos, es cualquier situación médica desfavorable que a cualquier dosis causa la muerte, amenaza la vida, causa la hospitalización o la prolonga. Da como resultado incapacidad/ discapacidad persistente o significativa.
Evento adverso grave esperado listado: Es un evento adverso serio cuya especificidad o seriedad no es consistente con lo descrito en el folleto (brochure) del investigador/información básica de prescripción o en la etiqueta del producto.
Evento adverso no esperado no listado: Es un evento adverso serio cuya especificidad o severidad es consistente con lo descrito en el folleto (brochure) del investigador/ información básica de prescripción o en la etiqueta del producto.
Evento adverso grave mortal: Todo evento que causa la muerte del paciente.
Efecto secundario: Efecto que no surge como consecuencia de la acción farmacológica primaria de un medicamento, sino que constituye una consecuencia eventual de esta acción; por ejemplo, la diarrea asociada con la alteración del equilibrio de la flora bacteriana normal que es producto de un tratamiento antibiótico. En sentido estricto, este término no debe emplearse como sinónimo de efecto colateral.
Evento adverso: Cualquier episodio médico desafortunado que puede presentarse durante el tratamiento con un medicamento, pero que no tiene relación causal necesaria con ese tratamiento. Aunque se observa coincidencia en el tiempo, no se sospecha que exista relación causal.
Problemas Relacionados con la Utilización de Medicamentos (PRUM): Corresponden a causas prevenibles de Problemas Relacionados con Medicamentos, asociados a errores de medicación (prescripción, dispensación, administración o uso por parte del paciente o cuidador), incluyendo los fallos en el Sistema de Suministro de Medicamentos, relacionados principalmente con la ausencia en los servicios de procesos administrativos y técnicos que garanticen la existencia de medicamentos que realmente se necesiten, acompañados de las características de efectividad, seguridad, calidad de la información y educación necesaria para su uso correcto.
Reacción adversa a los medicamentos (RAM): Según la OMS, “reacción nociva y no deseada que se presenta tras la administración de un fármaco, a dosis utilizadas habitualmente en la especie humana, para prevenir, diagnosticar o tratar una enfermedad, o para modificar cualquier función biológica». Nótese que esta definición implica una relación de causalidad entre la administración del medicamento y la aparición de la reacción. En la actualidad se prefiere “ Efecto no deseado atribuible a la administración de…» y reservar la definición original de la OMS para el concepto de acontecimiento adverso, el cual no implica necesariamente el establecimiento de una relación causa a efecto. Nótese, además, que esta definición excluye las intoxicaciones y sobredosis.
¨Definiciones tomadas de Documento técnico Nº. 5 Red PARF Buenas Prácticas de Farmacovigilancia para las Américas¨.
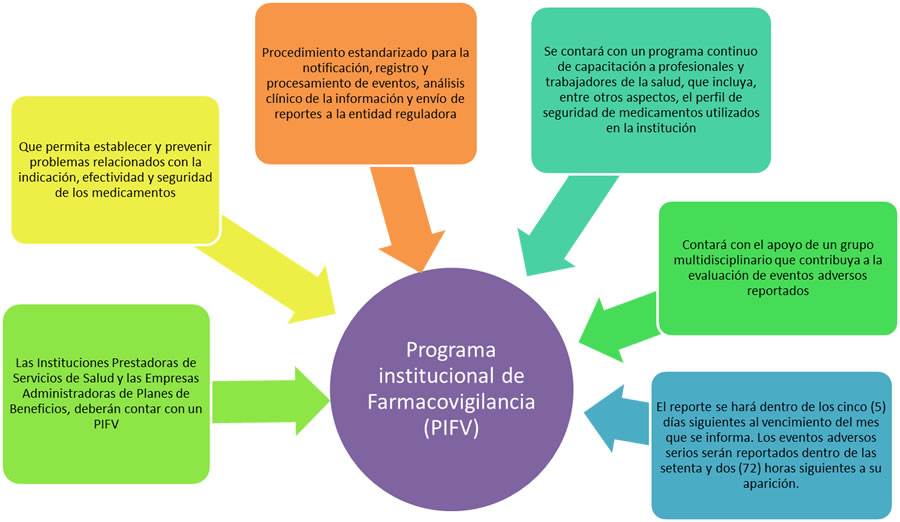
Programa Institucional de Farmacovigilancia
Inscripción a la Red Nacional de Farmacovigilancia
Para realizar la inscripción a la Red Nacional de Farmacovigilancia, revise el tutorial en el siguiente enlace:
Reporte
Guía para el reporte de eventos adversos asociados al uso de medicamentos.
Si realiza el reporte de sospecha de eventos adversos a medicamentos de forma manual, enviar el reporte con la periodicidad establecida por la normatividad vigente al INVIMA y a la Secretaría de Salud del Tolima al correo farmacovigilanciareportes@saludtolima.gov.co
El reporte de eventos adversos a medicamentos en línea tiene ventajas:
- Aumenta la calidad y oportunidad del reporte.
- Realiza de forma automática el análisis de causalidad
Circulares del Departamento
Circular 0317 27 Oct 2016 – Inscripción a la Red Nacional de Farmacovigilancia en línea
Enlaces relacionados
ABC Seguridad en el uso de medicamentos
Alertas de seguridad de medicamentos consolidadas por años
Próximo evento

